Schwerpunkt der Forschung am Institut für Physiologie und Pathophysiologie ist die Untersuchung von kardiovaskulären Verkalkungen, insbesondere der medialen Gefäßverkalkung (Mönckeberg-Mediasklerose).
Mediale Gefäßverkalkung bezeichnet die Ablagerung von Kalzium-Phosphat in den Muskelschichten der Arterien. Die mediale Gefäßverkalkung unterscheidet sich von der typischen Atherosklerose, die mit Bildung atherosklerotischer Plaques in den inneren Arterienschichten auftritt. Die Entstehung der klassischen Atherosklerose wird durch „traditionellen“ Risikofaktoren gefördert, wie unter anderem Rauchen, Dyslipidämie oder Adipositas. Bei der medialen Gefäßverkalkung spielen auch sogenannte „nicht-traditionelle“ Risikofaktoren eine Rolle, am bedeutendsten ist dabei wahrscheinlich Phosphat.
Diese Gefäßverkalkung tritt im Rahmen des Alterungsprozesses auf, deren Auftreten wird aber bei Niereninsuffizienz und Diabetes Mellitus stark beschleunigt. Auch existieren angeborene Veränderungen, die eine vorzeitige Gefäßverkalkung verursachen können. Bis vor kurzem wurden diese Verkalkungen noch als harmloser Degenerationsprozess interpretiert. Diese Ansicht wurde anhand intensiver Forschungsarbeiten in den letzten 15 Jahren aber geändert. Das Auftreten derartiger Verkalkungen wurde mit einem deutlich erhöhten Risiko für kardiovaskuläre Ereignisse, wie Herzinfarkt und Schlaganfall verknüpft. Die Ursachen dieser Assoziation und ein kausaler Zusammenhang sind bislang noch nicht eindeutig belegt. Vermutlich führt die Verkalkung der Gefäße zu einer Versteifung der Gefäßwand und führt so zur Belastung des Herzens mit diastolischer Dysfunktion. Ebenso könnte die Autoregulation der Organdurchblutung durch Verkalkungen gestört werden. Es wird auch vermutet, dass die Stabilität atherosklerotischer Plaques durch Verkalkung beeinflusst wird.
Ektope kardiovaskuläre Verkalkungen wurden mittlerweile als aktiver und regulierter Prozess erkannt. Bei der medialen Gefäßverkalkung spielen die glatten Gefäßmuskelzellen wahrscheinlich eine zentrale Rolle. Die zugrunde liegenden Mechanismen sind aber noch nicht im Detail verstanden, und es gibt noch keine breit anwendbare Behandlungsmöglichkeit. Weitere Forschungsarbeiten sind dringend benötigt, um die Bedeutung und Mechanismen der medialen Gefäßverkalkungen zu verstehen, und möglicherweise durch neue Behandlungen das kardiovaskuläre Überleben zu verbessern.
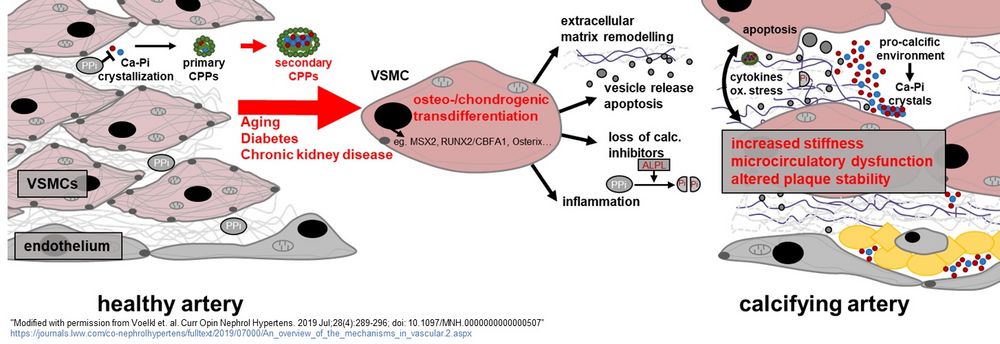 Abb. 1: Aktuelle Hypothesen über Mechanismen und Folgen der medialen Gefäßverkalkung
("Modified with permission from Voelkl et. al. Curr Opin Nephrol Hypertens. 2019 Jul;28(4):289-296; doi: 10.1097/MNH.0000000000000507); https://journals.lww.com/co-nephrolhypertens/fulltext/2019/07000/An_overview_of_the_mechanisms_in_vascular.2.aspx
Abb. 1: Aktuelle Hypothesen über Mechanismen und Folgen der medialen Gefäßverkalkung
("Modified with permission from Voelkl et. al. Curr Opin Nephrol Hypertens. 2019 Jul;28(4):289-296; doi: 10.1097/MNH.0000000000000507); https://journals.lww.com/co-nephrolhypertens/fulltext/2019/07000/An_overview_of_the_mechanisms_in_vascular.2.aspx
Unserer Nahrung wird heutzutage im Rahmen der industriellen Prozessierung stark Phosphat zugesetzt (zB E-339). Ein gesunder Mensch kann diese Phosphatbelastung durch renale Ausscheidung wahrscheinlich fast komplett kompensieren. Ebenso bildet der menschliche Körper spezielle Schutzmechanismen, die vor einer ektopen Verkalkung schützen. Dazu zählt zB die Bildung von Pyrophosphat und körpereigene Proteine wie Fetuin-A und Matrix-GLA Protein. Dieses „Anti-kalzifizierende System“ verhindert die ektope Kristallisation von Kalzium und Phosphat. Wenn dieses System geschwächt wird, oder überlastet wird, können Gefäßverkalkungen entstehen.
Besonders bei eingeschränkter Nierenfunktion entwickelt sich eine Hyperphosphatämie, die als einer der stärksten Stimulatoren von Gefäßverkalkungen erkannt wurde. Paradoxerweise führen die körperlichen Veränderungen bei chronischer Niereninsuffizienz zu einem Abbau von Knochenmineralien, die dann die Gefäße mineralisieren. Es gibt aber auch zahlreiche Hinweise, dass Phosphatbelastung bei Nierengesunden schädliche Wirkungen vermittelt. Ein Forschungsschwerpunkt sind diese Regulationsmechanismen und Fehlregulationen des Phosphathaushalts, sowie mögliche schädliche Effekte der Phosphatbelastung, wie Herzhypertrophie und Gefäßversteifung.
Phosphat, aber auch Hyperglykämie und entzündliche Prozesse werden von glatten Gefäßmuskelzellen wahrgenommen. Diese Gefäßmuskelzellen haben die außerordentliche Fähigkeit, Ihren Phänotyp umzuwandeln, und können sich in Zellen mit osteoblastischen und chondroblastischen Eigenschaften umwandeln. Diese transdifferenzierten Gefäßmuskelzellen hemmen körpereigene Mineralisationsinhibitoren, bauen die extrazelluläre Matrix um, fördern inflammatorische Prozesse, neigen vermehrt zu Apoptose, und geben zelluläre Vesikel frei. Diese Prozesse vermitteln eine aktive und regulierte Mineralisierung der Gefäßwand.
Dabei existiert ein komplexes Netzwerk an zellulären Signalkaskaden, die eine osteo-/chondrogene Transdifferenzierung in den Gefäßmuskelzellen auslösen und steuern können. Ein therapeutischer Eingriff an Schlüsselstellen der Signalkaskaden könnte zu einer effektiven Behandlung der Gefäßverkalkung führen, und das kardiovaskuläre Risiko der betroffenen Patienten möglicherweise stark senken. Wir untersuchen daher inflammatorische Signalwege, die eine Gefäßverkalkung fördern, und versuchen diese Erkenntnisse in neue Behandlungsstrategien umzusetzen.
Wir bedanken uns bei den FördergeberInnen, die unsere Studien unterstützen und ermöglichen: